Ecología y evolución de hantavirus en el Cono Sur de América (página 2)
Los roedores que portan a los hantavirus pertenecen a
la Familia
Muridae y dos subfamilias Murinae y Arvicolinae, roedores
llamados también del viejo mundo, que se distribuyen en
las áreas geográficas de Europa, Asia y Oceanía.
Estas cepas de virus
desencadenan en el humano la enfermedad descrita como fiebre
hemorrágica con síndrome renal (FHSR) y
nefropatía epidémica (NE) (Hart y Bennett, 1994).
Por otra parte, los roedores llamados del nuevo mundo que se
distribuyen mayoritariamente en América
del Sur, Centro América y América del Norte
pertenecen a la sub familia
Sigmodontinae (figura 1) y la enfermedad que producen se ha
descrito como el SPH. (Duchin y col., 1994; Childs y col., 1999).
Observaciones en casos humanos de depresión
de la función
cardíaca y de shock severos y fatales (Hallin y col.,
1996) y como una forma de educar a médicos clínicos
sobre esta falla (Botten y col., 2000) se ha incorporado al
síndrome el concepto cardio
pulmonar. Por otra parte la sub familia Arvicolinae presenta
especies del género
Microtus que portan Hantavirus en el nuevo mundo (América
del Norte), sin embargo, estos virus no han sido asociados hasta
la fecha con casos humanos del Síndrome Pulmonar por
Hantavirus (SPH).

FIGURA 1.
Familias de roedores representados en Chile (según Redford
y Eisenberg 1993).
Los sombreados corresponden a las familias en las que se ha
detectado presencia de anticuerpos de hantavirus.
Families of rodents represented in Chile (according to
Redford and Eisenberg 1993). Filled squares are families in wich
has been detected antibodies of hantaviruses.
Estudios realizados sobre las relaciones
filogenéticas entre grupos de
roedores portadores de hantavirus y de los virus entre sí,
han mostrado fuertes similitudes al ser comparados de forma que
la filogenia del virus refleja muy estrechamente la filogenia de
los roedores (Xiao y col., 1994), lo que ha sugerido una
asociación entre los huéspedes y sus virus de mucho
más larga data de lo que se suponía inicialmente
(Spotorno y col., 2000) con un proceso de
coevolución entre los agentes infecciosos y sus
huéspedes roedores (Mc Caughey y Hart, 2000).
El hecho de que los diferentes hantavirus reportados
hasta la fecha estén relacionados con una familia de
roedor común, sugiere la propuesta de que los hantavirus
han coevolucionado con roedores múridos
originándose en América del Norte y no en Europa
durante el Oligoceno (Smaljohn y Hjelle, 1997) antes del momento
de separarse en las subfamilias y anterior al ingreso de los
sigmodontinos al continente sudamericano.
Estos antecedentes sugieren que para comprender en su
real dimensión la historia evolutiva de la
biota en general y de los roedores en particular, es necesario
conocer como los cambios tectónicos y climáticos
afectaron a los continentes en épocas pretéritas y
de que forma ellos pudieron influenciar las distribuciones
presentes en nuestros días.
BIOGEOGRAFÍA HISTÓRICA
DE SIGMODONTINOS Y HANTAVIRUS
Los roedores evolucionaron de un grupo basal
conocido como Paramydae en el Paleoceno tardío en el
Neártico hace 55-60millones antes del presente (Vaughan,
1972). No existen datos exactos de
cuándo se produjo la separación de los roedores que
colonizan Europa, Asia y Oceanía, sin embargo, el grupo
debió extender su rango geográfico de distribución a través de la ruta de
dispersión entre Alaska y Siberia, conocido como Estrecho
de Bearing en el Cenozoico temprano, cuando prevaleció un
clima suave,
lo que permitió un continuo intercambio de organismos de
modo tal que las Regiones Neárctica y Palearctica
comparten hoy día numerosas especies y se la considera
como una súper región, Holoártica (Brown y
Lomolino, 1998). De estos antecedentes se puede inferir que los
Múridos llegaron a Siberia alrededor de los 30 millones de
años antes del presente.
La posibilidad de intercambio de fauna entre el
Neártico (América del Norte) y el Neotropical
(América del Sur) ocurrió en varias oportunidades
previo al puente centro americano que representa el Istmo de
Panamá.
Este puente pudo haber existido a fines del Cretácico (80
millones antes del presente) como una cadena de islas que
derivó entre las Placas Caribeña y de Cocos
(Briggs, 1994). Existen evidencias
biogeográficas de invertebrados marinos y de algunos
intercambios de mamíferos (posiblemente caviomorfas),
reptiles, ranas y peces de
agua dulce
(Gayet y col., 1992; Briggs, 1994). Un segundo puente se genera
durante el Mioceno (entre 5 a 10 millones de años antes
del presente) en que el archipiélago centro americano
proporciona una ruta para saltadores de islas de una variedad de
organismos terrestres por cambio de 50m
en el nivel de agua oceánico (Brown y Lomolino, 1998). Es
en esta misma época geológica que dos autores Reig
(1981) y Webb y Marshall (1982) postulan el ingreso de los
roedores sigmodontinos entre los 5-6 millones de años
antes del presente. El hallazgo de un nuevo fósil en lo
que es hoy Argentina central (provincia de Buenos Aires y La
Pampa), muestran que la diversidad de los sigmodontinos y su
diversificación fue más temprana (Pardiñas y
col., 2002) y líneas de sigmodontinos reconocidas
habitaban esa región 5 a 6 millones antes del presente
(D´Elia, 2003).
Los datos de registros
fósiles combinados con los de análisis filogenético del mt DNA
confirman que los ancestros de los sigmodontinos sudamericanos
entraron a Sudamérica desde Centroamérica
vía saltadores de islas 5 a 10 millones de años
atrás (Engel y col., 1998).
La distribución de biota en Sudamérica es
influenciada claramente por la alternancia de episodios glaciales
e interglaciares que ocurrieron en forma cíclica en el
Pleistoceno. Estos ciclos secos fríos y húmedos
cálidos permitieron avance y retracción de biomas de
bosque alrededor de las cuencas de los ríos Orinoco y
Amazonas liberando un corredor por la vertiente oriental de la
cordillera de los Andes que alcanza tan al sur como la costa
centro sur Argentina en Monte Hermoso (38º 59' Latitud Sur,
61º 18' Longitud Oeste). Es en este lugar en donde se
encontró el primer fósil sigmodontino de 3.5
millones de años antes del presente coincidente
también con la primera glaciación (Marshall, 1979).
La fauna se dispersó a lo largo del corredor descrito,
concentrándose en lo que hoy es Chaco paraguayo,
centro-norte argentino, sur de Brasil y Uruguay y
desde ahí cruza la cordillera de los Andes
distribuyéndose en la Puna altiplánica (figura 2).
Las evidencias paleo climáticas así como los
patrones actuales de diversidad de la zona indican que es un
centro de diversificación tanto para aves como
roedores sigmodontinos (Reig, 1986; Vuillemier y Simberlof,
1980). Es posible que desde la zona del altiplano pequeños
mamíferos migraran hacia el oeste, el desierto y hacia el
sur por el oeste de los Andes durante períodos de grandes
lluvias y lagos, pero otros desviaron su distribución
hacia el este o se detuvieron en la extensión de su rango
geográfico (Moreno y col., 1994). La colonización
del sur de Chile se hace más comprensible a través
de corredores transandinos desde el este al oeste, lo que se ve
respaldado por la enorme similitud de fauna entre transectos a la
misma latitud y entre la zona central de Chile y la patagonia
argentina. (Moreno y col., 1994). Durante los períodos de
glaciación la vegetación subantártica se
deslizó hacia el norte por la ladera de la Cordillera de
los Andes distribuyendo también a la fauna asociada al
bosque siempre fríos (Vuilleimier, 1971), cuyos ensambles
de mamíferos alcanzaron por esta vía latitudes
septentrionales.
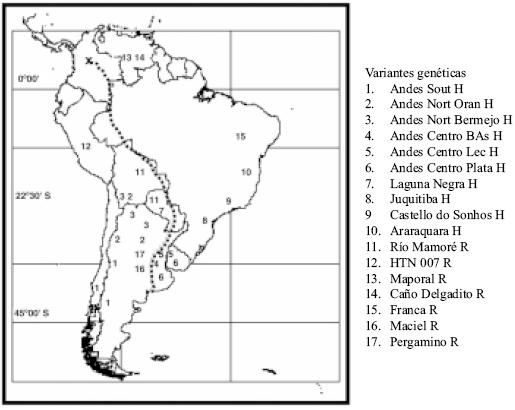
FIGURA 2.
Mapa de distribución de los virus detectados en
Sudamérica. Los indicados con H producen enfermedad en
humanos y los R han sido caracterizados sólo en
roedores.
La línea punteada indica la ruta de dispersión
desde la entrada a Sudamérica (x) hasta Monte
Hermoso.
Distribution of viruses detected in South America.
Indicated with H produce disease in humans, and those with R only
are present in rodents. Point line shows possible dispersal route
and entrance (X) toward South America at Monte
Hermoso.
HANTAVIRUS EN EL CONO SUR DE
AMÉRICA
El virion, estructura y
organización. El origen de los virus RNA es
incierto, sin embargo, es razonable asumir que estos agentes
infecciosos tienen una historia evolutiva larga apareciendo con o
quizás antes de la primera forma de vida celular, basada
en que estos virus evolucionaron con sus huéspedes
vertebrados. Para el caso de los hantavirus, si la historia
inferida de coespeciación de virus y roedores es correcta,
entonces la tasa de sustitución nucleotídica de
estos virus debe de haber sido mucho más baja que la
reportada para otros virus RNA, de lo contrario sus secuencias
genéticas hubieran sido irreconociblemente divergentes
(Holmes, 2003). Los virus del género hantavirus tienen una
organización genómica consistente en tres segmentos
de RNA monocatenario denominados según su tamaño L
(large), M (medium) y S (small). El segmento L codifica para la
proteína L con actividad de transcriptasa/replicasa, el M
para una proteína precursora de las glicoproteínas
G1 y G2 que se generan por el clivaje de la precursora en un
sitio específico y el segmento S codifica para la
proteína de la nucleocápside N. Cada segmento de
RNA está rodeado por moléculas de proteína N
formando una cápside de estructura helicoidal que se
circulariza uniendo sus extremos. Los viriones son envueltos,
sensibles a solventes lipídicos y detergentes y los virus
son de difícil cultivo (Schmaljohn, 1996).
Análisis filogenético viral. Por ser el
SPH una enfermedad de reciente descubrimiento es importante
además de la realización del diagnóstico serológico la
caracterización del hantavirus asociado a cada caso
ocurrido o a cada roedor serológicamente positivo
capturado.
Para determinar la especie viral involucrada en la
infección en humanos y en roedores en el Cono Sur de
América, se realizó un análisis
filogenético de máxima parsimonia, basado en las
diferencias nucleotídicas de fragmentos del segmento viral
M correspondiente a zonas codificantes para las
glicoproteínas G1 y G2 (posición 26 a 281 y 1753 a
2946) de casos confirmados en comparación a hantavirus ya
caracterizados.
Todos los casos correspondieron a variantes
genéticas del virus Andes (AND) o Laguna Negra (LN)
(Padula y col., 2000a; Padula y col., 2002a,b). Dentro de las
variantes genéticas del virus Andes se pudieron distinguir
al menos 6 linajes genéticos: (i) el linaje AND Sout se
caracterizó a partir de casos del sur de Argentina y
Chile, (ii) el linaje AND Nort Oran en las provincias de Salta y
Jujuy de Argentina y en el sur de Bolivia, (iii)
AND Nort Bermejo, en el norte Argentino y sur de Bolivia, (iv)
AND Cent Bs. As., asociado al 80% de los casos de la provincia de
Buenos Aires y el cual incluye al genotipo Hu39694 reportado
previamente (Levis y col., 1998), (v) el linaje AND Cent Lec en
las zonas ribereñas de la misma provincia, el cual incluye
al genotipo Lechiguanas (LEC) reportado previamente (Levis y
col., 1998), (vi) un nuevo linaje al que denominamos AND Plata
fue caracterizado a partir de casos de un lado y otro del
Río de la Plata (Argentina y Uruguay) (Padula y col.,
2000b; Delfraro y col., 2003). El rango de identidad
nucleotídica y aminoacídica de los linajes del
virus Andes oscila entre el 76.5% al 86.6% y del 91.9% al 96.9%
respectivamente. La evolución de los virus RNA es más
compleja porque los genomas virales son un mosaico de sitios
sinonímicos, o sea donde las mutaciones no cambian el
código
de aminoácidos y de no sinonímicos, sitios donde
las mutaciones alteran aminoácidos y las cuales
evolucionan más lentamente. Se ha observado disparidad
entre tiempo de
divergencia e historia filogenético, que requiere
establecer una escala de tiempo
de evolución viral basada en determinaciones más
ajustadas de la tasa de sustitución nucleotídica
(Holmes, 2003).
Un estudio filogenético más detallado que
se realizó en la provincia de Buenos Aires mostró
que durante el periodo 1997 a 2000 el 63% (24/ 39)
correspondió al linaje AND Bs.As., el 20.5% (8/39) al AND
Cent Lec, y el resto 15% (6/39) al AND Cent Plata.
(Martínez y col., 2001) Solamente 3 muestras no pudieron
amplificarse. El virus de un caso fue identificado asociado al
linaje AND Sout confirmándose que el paciente había
viajado al sur de Argentina, provincia de Neuquén 20
días antes del comienzo de los síntomas. En una de
las localidades de la provincia de Buenos Aires cocircularon dos
linajes AND Cent Plata y AND Cent Bs.As. asociados a casos de
SPH. En la parte norte de la provincia sólo se
encontró el linaje AND Cent Lec.
De un total de 9 virus amplificados de casos de Paraguay, 7
fueron caracterizados como LN. Los otros 2 casos estaban
infectados con virus muy similares entre sí, pero con una
divergencia del 25% y del 16% nucleotídica y aminoacidica
respectivamente cuando se compararon con el virus LN en un
fragmento de 672 nucleótidos analizados. Estos 2 genotipos
resultaron ser más similares a los linajes de virus AND en
un rango de identidad nucleotídica y aminoacídica
que varió del 78.6% al 80.6% y del 93.2 al 95.0%
respectivamente. Estas secuencias agruparon juntas con los
linajes de virus AND en el árbol filogenético con
un alto valor de
confianza. (Padula y col., 2000a).
Cuando se analizó la severidad del SPH se
encontraron casos severos y moderados entre pacientes infectados
con los 6 linajes de AND. Ocasionalmente se reportaron casos con
claros signos
hemorrágicos con virus pertenecientes a AND Sout, AND Nort
y AND Cent Bs. As. Comparando los tres linajes del virus AND de
Buenos Aires se obtienen valores bajos,
entre un 3% a 6% de divergencia aminoacídica. En general,
si bien una relación directa entre datos genéticos
y serológicos es difícil de mostrar, el criterio
tradicional serológico correlaciona muy bien con los datos
moleculares. Normalmente, la baja divergencia en
aminoácidos indica neutralización cruzada entre
cepas virales. Hasta el momento no existen suficientes evidencias
para considerar a los seis linajes asociados a SPH circulantes en
Argentina como diferentes virus. Por ese motivo y hasta tanto se
obtengan datos de seroneutralización cruzadas que
confirmen si se trata de entidades virales diferentes, optamos
por denominar a las variantes obtenidas a partir de Oligoryzomys
con el nombre AND con el agregado de un nombre indicativo del
lugar. Otros autores prefieren denominar "AND like" a los
genotipos relacionados. La investigación de datos geográficos y
ecológicos basados en mantenimiento
y coevolución de diferentes reservorios primarios
contribuirá a la asignación del estado
taxonómico del virus AND. Mas aún, a medida que se
obtengan nuevos virus caracterizados de la región, tal es
el caso de los virus de Brasil (Johnson y col., 1999, Mendes y
col., 2001) y de Panamá (Vincent y col., 2000), se
podrá observar que cada vez es mayor el número de
hantavirus que circulan con diferencias pequeñas entre
sí como para no considerarlo especies virales diferentes
sino genotipo, los que a su vez se agrupan en linajes. Sin
embargo, a pesar de las diferencias, no son lo suficientemente
similares entre linajes o genotipos de distintas regiones
geográficas, lo que permite en la mayoría de los
casos poder
identificar el lugar de infección. A medida que otros
virus caracterizados se incorporen a las bases de datos y
se realicen pruebas de
neutralización cruzada entre cepas, se podrá
definir o agrupar en distintas especies virales.
Distribución Geográfica. Para los
hantavirus se reconoce que la distribución
geográfica del huésped determina la
distribución del virus y en consecuencia la enfermedad en
humanos (Hart y Bennett, 1999), por lo que en esta forma
indirecta se puede establecer las rutas de
dispersión.
Los hantavirus descritos en Sudamérica se
concentran en el área del corredor de dispersión
que los mamíferos utilizaron en su penetración
hacia el sur del continente durante el cuaternario (Marshall,
1979), en parte de Bolivia, expandiéndose hacia el sur
este y centro norte de Argentina y patagonia, lo que sugiere un
centro de radiación
del virus en esa área. Así estudios realizados en
el genoma S de las secuencias nucleotídicas de siete
genotipos de hantavirus en Argentina indican que las cepas Rio
Mamore y Lechiguanas forman un clado separado que ocupa una
posición ancestral del resto del grupo (Morzunov y col.,
2001). Por otro lado los huéspedes del virus Andes Nort
Oran y los descritos en Brazil (Juquitiba, Castello do Sonhos y
Araraquara) aparecen aislados por la costa norte oriental de
Brasil. Esta pudo ser una vía de colonización hacia
el sur alternativa de los huéspedes roedores cuya
respuesta se podría conocer mediante análisis
filogenético de los virus determinando cuáles son
más recientes o antiguos.
Mediante la obtención de las secuencias
nucleotidicas de la región más variable del DNA
mitocondrial (mtDNA) se construyó un árbol
filogenético conteniendo varios de los huéspedes de
hantavirus particularmente aquellos de la subfamilia
Sigmodontinae (Engel y col., 1998,). El análisis
filogenético de los hantavirus basado en la secuencia
nucleotídica completa del segmento S o M, revela un
árbol filogenético muy similar al de los roedores.
Dentro de los virus asociados a sigmodontinos los de
Sudamérica forman un agrupamiento muy bien consensuado y
separado de los peromyscines de Norteamérica. Los virus
hospedados por Oligoryzomys son monofiléticos entre
sí y forman con el virus LN (Johnson y col., 1997) de
Paraguay, cuyo reservorio es Calomys laucha, y el Rio Mamore (RM)
(Bharadwaj, 1999), de Bolivia en Oligoryzomys microtis, un
taxón hermano. La inconsistencia en que dos virus
hospedados por Calomys y Oligoryzomys respectivamente formen un
taxón es sugestiva de un evento de cambio de
huésped (host-switching) entre roedores muy
relacionados.
Otro hecho de interés es
la presencia de la cepa Andes Sout, descrita en la patagonia
Argentina (López y col., 1997) y en diferentes zonas
ecológicas de Chile. En efecto, estudios de PCR realizados
de órganos de animales
positivos colectados a lo largo de Chile (V Región por el
norte y Undécima por el sur) han mostrado la presencia de
la misma cepa de virus. Este hecho de alguna forma refuerza la
propuesta que la colonización de los sigmodontinos se
realizó a través de los pasos cordilleranos desde
Argentina a Chile. En Argentina la cepa Andes Sout tienen un
extenso rango geográfico por la vertiente oriental de la
Cordillera de los Andes hacia la patagonia (figura 2). En esta
misma dirección argumental, el hecho ya aceptado
que cada hantavirus tiene un roedor reservorio que es especie
específico explica la existencia de un solo reservorio del
virus en Chile, aunque ocurre que pueden existir otras especies
de roedores sigmodontinos que podrían servir de
huéspedes vectores del
virus. En Chile se han encontrado animales serológicamente
positivos al virus Andes Sout en especies que coexisten con el
reservorio, en los mismos hábitats, como son Akodontinae,
Phyllotynae (Pavletic, 2000). Es más, se ha logrado en
forma experimental infectar individuos Akodon olivaceus los que,
a su vez, en un intento preliminar con pocos animales no han
podido infectar a otros, lo que confirmaría la
especificidad (Padula y col., en prensa
2004).
La presencia de varios ríos en la zona central de
Argentina pudo haber sido utilizada como vehículo para que
las especies de roedores fueran transportadas en pequeñas
islas flotantes río abajo y así explicar la
existencia de estos tres linajes circulantes en la región
central, en contraste con un solo linaje en la zona sur
(Chiappero y col., 1997). El linaje AND Nort Oran fue
caracterizado a partir de 2 roedores O.longicaudatus (Levis y
col., 1998), 2 O.chacoensis y 1 O. flavescens (González
Della Valle y col., 2002) pudiendo interpretarse estos resultados
como derrame (spill over) entre especies o como adaptación
en las 3 especies de Oligoryzomys. Asignar una de estas especies
como reservorio de este linaje utilizando un número tan
pequeño de animales analizados no se considera lo mas
apropiado. En efecto en Paraguay el virus LN también ha
sido caracterizado a partir de Calomys callosus (Almiron y col.,
2003), roedor importante para las zoonosis por
ser el reservorio del virus Machupo, agente causal de la Fiebre
Hemorrágica Boliviana. Sin embargo, el número de
roedores C. laucha infectados es muy superior, por lo cual se le
atribuye el rol de reservorio, desconociéndose aún
la importancia de la especie C. callosus.
Existe gran dificultad en Sudamérica en demarcar
una especie nueva de virus hanta y hasta el momento ha sido
arbitraria. Sin embargo, los estudios filogenéticos
aún no completos de distintas cepas obtenidas de casos
humanos en el norte de Argentina, Bolivia, Chile, sur y norte de
Brasil, Paraguay y Uruguay parecerían agruparse alrededor
de 2 únicas especies de virus diferentes: el virus Andes y
el LN y de 2 géneros reservorios, el Oligoryzomys y el
Calomys. Tal es el caso del hantavirus HTN-007 caracterizado en
un O. Microtis de Perú, que tiene una identidad del 85-
87% con el virus Rio Mamore de Bolivia (Bharadwaj y col.,
1999).Todas las otras cepas, así, como la de Perú,
pudieran representar variantes de algunas de estos dos virus ya
que cuando se comparan a nivel de proteínas
las diferencias son significativamente menores llevando a suponer
una probable neutralización cruzada entre cepas. La
dificultad existente en el aislamiento de los hantavirus a partir
de sigmodontinos se ve reflejada en la ausencia de datos de
relaciones serotípicas entre estos virus, así como
la existencia de determinantes comunes de neutralización.
Hasta la actualidad el criterio para designar una nueva especie
de hantavirus ha sido inconsistente y un poco arbitrario. Un
criterio provisorio ha sido reunir en linajes a aquellas cepas o
genotipos relacionadas por género de roedores
huéspedes, no de especies, relacionadas
geográficamente y con diferencias genéticas
nucleotídicas de alrededor del 20% y aminoacidicas del 8%
(Padula y col., 2000a) Además, los futuros estudios
taxonómicos en roedores permitirán el
análisis de la co-especiacion y las relaciones
filogenéticos de hantavirus en humanos y sus respectivos
huéspedes.
Epidemiologia molecular de los Hantavirus La importancia
de la caracterización genética
de virus a partir de casos y roedores es poder correlacionar
fuentes de
infección y enfermedad y así poder predecir
patrones de riesgo.
Con el fin de poder realizar una clasificación
genética que permitiera conocer el sitio geográfico
de contagio se analizaron numerosas regiones del genoma de AND.
Teniendo en cuenta que el período de incubación de
la enfermedad puede llegar a ser de 30 días, la información epidemiológica en muchos
casos no permite decidir el lugar de contagio, sobre todo en los
casos de personas que por razones laborales se desplazan grandes
distancias. La región del segmento M comprendida entre los
nucleótidos 2721 y 2946 (numeración relativa al
virus Andes) que codifica para la glicoproteína de
envoltura G2 se amplificó, secuenció y
analizó con dicho propósito. Se compararon las
secuencias de a pares correspondientes a 70 casos y se calcularon
los porcentajes de similaridad.
La distribución de frecuencias de porcentajes de
similaridad de esta región se separó en 3 grupos.
La similaridad fue alta, entre 90 al 100% cuando se comparan
casos del mismo linaje, e intermedios, entre el 74 al 86% entre
casos de diferente linajes o diferentes virus, pero
pertenecientes al Cono Sur de America i.e LN vs. AND. La
similaridad fue baja, entre el 63 al 78%, cuando se compararon 2
virus de diferentes hemisferios o entre virus diferentes de
Norteamérica i.e BAYOU vs. NEW YORK or AND Sout vs.
SN.
ECOLOGIA, TRANSMISIÓN DE LA
ENFERMEDAD
La distribución y ecología de los
roedores huéspedes define en forma amplia la
epidemiología de los hantavirus, considerando que las
características del hábitat
determinan condiciones de mayor abundancia poblacional y
estructura demográfica (edad y sexo) en
sitios de más alto riesgo que en los sitios de menor
riesgo (Glass y col., 2002). La variación en el riesgo que
se observa año a año parece estar más
asociado a características efímeras del paisaje que
afectan a la población reservorios más que la
propia vegetación del lugar (Glass y col., 2002). La
estructura del paisaje definida en términos de
composición y configuración que corresponde a los
tipos de manchones (patches) existentes, la cantidad de cada uno
y las relaciones entre ellos tienen un importante efecto en la
distribución de virus (Langlois y col., 2001). El proceso
de fragmentación del paisaje aumenta su conectividad y el
mayor movimiento del
ratón venado (Peromyscus manisculatus) en habitats
fragmentados (Diffendorfer y col., 1995), por lo que se ha
propuesto que la tasa de transmisión de la enfermedad se
aumentaría en los paisajes fragmentados (Langlois y col.,
2001). Estos tipos de paisajes son característicos
también en la zona sur chilena, en que los bosques han
sufrido una fuerte intervención humana, ya sea por
explotación maderera o sustitución por otras
plantaciones, lo que ha formado fragmentos de diferentes
tamaños y conectividad que tendrían efectos en la
distribución del hantavirus.
El principal modo de transmisión del virus Sin
Nombre (SN) al ser humano es la inhalación de
partículas de virus transportada por el aire, liberadas
de las fecas y orina de los roedores infectados a medida que se
secan (Langlois y col., 2001).
Es ampliamente aceptado que la transmisión del
hantavirus en una población de reservorio es horizontal y
el mecanismo de transferencia serian los encuentros agresivos y
mordeduras frecuentes entre los machos (Mills y col., 1999a),
esto ocurriría en forma más frecuente durante el
periodo de apareamiento, primavera-verano, que coincide con las
más elevadas seroprevalencia observadas en las poblaciones
de reservorios (Douglass y col., 2001). El razonamiento es que en
densidades elevadas se aumenta el contacto roedor-roedor con el
incremento de las posibilidades de transmisión del virus a
roedores susceptibles, con elevada incidencia total y prevalencia
acumulativa (Mills y col., 1999b). Esta propuesta se ve
respaldada por el modo de transmisión teórico,
densidad-dependiente, también conocido como
acción
masiva (mass action) (Dobson y Hudson, 1995) o más
recientemente como pseudo acción masiva (Begon y col.,
1999). Sin embargo, no se han encontrado evidencias claras entre
el aumento de la seroprevalencia y la densidad poblacional tanto
en virus SN en Norte América (Mills y col., 1999b) como en
virus AND en Sudamérica (Cantoni y col., 2001;
Murúa y col., 2003) e incluso datos recopilados muestran
una relación inversa entre la densidad poblacional y la
prevalencia de anticuerpos (Abbott y col., 1999; Douglass y col.,
2001). Lo que sí se ha encontrado es una relación
positiva entre el número promedio de huéspedes
positivos y el promedio de la abundancia total de roedores
(Douglass y col., 2001; Murúa y col., 2003).
Otro modo alternativo de transmisión es la
frecuencia dependiente o también llamado mezcla
proporcionada, donde los huéspedes se asume hacen un
número fijo de contactos con otros huéspedes (Begon
y col., 1999). Este modo de transmisión se ha asociado
principalmente con enfermedades transmitidas en
forma sexual, pero recientemente se ha sugerido una relevancia
más amplia (De Jong y col., 1995). Así enfermedades
socialmente transmitidas pueden tener la misma dinámica de transmisión, en que la
frecuencia de los contactos entre los huéspedes son
independientes de la densidad (Begon y col., 1999). En
Oligoryzomys longicaudatus, roedor reservorio de virus Andes
(AND) en Argentina y Chile (López y col., 1997), existen
conductas sociales como identificación, monta, oler,
persecución, (González y col., 1990) que favorecen
el contacto físico no necesariamente agresivo entre
individuos de estas especies, así como con roedores de
especies que coexisten en el mismo hábitat. El ensamble de
roedores en el Sur de Chile y patagonia Argentina se caracteriza
por tres especies dominantes: Abrothrix olivaceus, Oligoryzomys
longicaudatus y Abrothrix longipilis que sobreponen sus
hábitats y se han detectado animales seropositivos de las
especies A.olivaceus (Toro y col., 1998) y A. longipilis
(Murúa y col., 2003) y Loxodontomys micropus en la
patagonia Argentina (Cantoni y col., 2001) en un fenómeno
conocido como derrame (spill-over) del virus en otros roedores
que entra en contacto. La vía de transmisión por
aerosol aparece como la más importante forma de
transmisión (Lundkvist y col., 1994). El mecanismo de
transmisión entre ratones y de éstos al hombre seria
entonces por inhalación de aerosoles con partículas
de virus que se liberarían de la saliva al secarse del
pelaje del roedor positivo después de su acicalamiento y
limpieza o de otros elementos contaminados (alimento, muebles,
cortinas) con ella. Esta hipótesis estaría avalada por el
hallazgo tanto en animales positivos a virus AND colectados del
terreno como infectados en condiciones experimentales, de la
presencia de RNA viral en glándulas salivales y
pulmón detectados por RT-PCR e inmunohistoquímica y
por RT-PCR en la saliva de animales (Padula y col., en prensa
2004). Esto además fortalece la evidencia de
transmisión de persona a persona
descrita por primera vez en el sur argentino en 16 casos a partir
de un caso índice, donde médicos tratantes
estuvieron expuestos sin mediar contacto con roedores sugiriendo
que al menos cadenas de tres pasajes ocurrieron en el hombre
(Enria y col., 1996; Wells y col. 1997; Padula y col., 1998).
Otra transmisión de persona a persona ha sido descrita en
una familia en la zona de Coyaique en la patagonia chilena,
durante una irrupción de casos humanos en 1997 (Toro y
col., 1998). El virus Andes (AND) es el primer hantavirus en el
mundo asociado a una enfermedad pulmonar transmitida persona a
persona (Padula y col., 1998). Se considera que el modo de
transmisión más probable en estas situaciones fue
el respiratorio (Mc Caughey y Hart, 2000). Un estudio más
reciente (Pinna y col., 2003) reporta una cadena de
transmisión interhumana de tres personas a partir del caso
de un paciente residente en Buenos Aires, que desarrolló
una infección por hantavirus sin haber tenido
ningún otro riesgo epidemiológico más que el
contacto con un caso previo en un viaje al sur de Argentina.
Posteriormente, un tercer caso residente de la provincia de
Buenos Aires, desarrolló SPH teniendo como antecedente de
riesgo varios encuentros con el caso anterior. Esta nueva
evidencia para el mecanismo de transmisión interhumana del
linaje AND Sout, tiene las características particulares de
haber ocurrido por un contacto ocasional, no repetido, pero
prolongado como un viaje de 14 hs en microbus de larga distancia
y fuera del área endémica.
La seroprevalencia en roedores presenta variaciones
estacionales siendo en el caso de virus SN más elevada en
primavera y más baja en otoño (Mills y col., 1999b)
situación que también se ha visto en virus AND en
la patagonia Argentina (Cantoni y col., 2001) y en el sur de
Chile (Murúa y col., 2003). La baja en otoño se
explicaría por el reclutamiento
de juveniles que tendría un efecto de dilución que
conduce a una baja de prevalencia de anticuerpos (Mills y col.,
1999b). La población de primavera consiste ampliamente de
roedores adultos que pasan el invierno, lo que refleja la alta
prevalencia de anticuerpos que se espera de poblaciones adultas
(Mills y col., 1999b).
La más alta prevalencia de anticuerpos se ha
encontrado en poblaciones con predominio de individuos adultos,
siendo mucho menos común en poblaciones con dominancia de
animales juveniles (Calisher y col., 1999). Este hallazgo ha
permitido proponer la hipótesis de que
la mantención del hantavirus en las poblaciones
reservorios ocurriría vía animales adultos
residentes, que mantendrían la infección de la
estación previa reintroduciendo el virus en animales
susceptibles cada primavera (transestacional) (Abbott y col.,
1999; Calisher y col., 1999; Mills y col., 1999a).
La hipótesis implica que poblaciones reservorios
residentes estables son necesarias para mantener la
infección de hantavirus en un sitio. Por el contrario,
poblaciones de reservorio con estructuras de
edades juveniles y de alto recambio poblacional mostrarían
baja tasas de infección de hantavirus, lo que ocurre en
poblaciones marginales en la periferia del rango de la especie
reservorio (Calisher y col., 2001). Este mecanismo podría
ser una explicación alternativa a la focalidad observada
en infecciones de hantavirus y a las prevalencia que pueden
fluctuar entre 0 a 60% en una escala regional (Calisher y col.,
2001). Recientemente, una hipótesis alternativa de la
mantención de hantavirus que producen FHSR se ha sugerido
basado en un modelo
epidemiológico con datos de campo, y es la
transmisión del virus por ambientes contaminados que le
permitirian alcanzar a un huésped susceptible sin la
presencia física
de un roedor infectado (Sauvage y col., 2003).
En Chile el SPH es una enfermedad endémica para
el hombre en el sur de Chile (Baró y col., 1999) que puede
transformarse cada ciertos períodos de tiempo en
epidémica a consecuencia de incrementos en las poblaciones
de roedores como resultados del aumento de recursos
alimentarios derivados de la semillación de una
bambúcea conocida como quila (Chusquea spp.), que favorece
el contacto entre humanos y roedores (Murúa y col., 2003).
La modificación del paisaje por la fragmentación de
la masa boscosa del sur chileno, favorece el desarrollo de
esta bambúcea que es muy agresiva en su desarrollo,
cubriendo inicialmente todo el espacio disponible y expandiendo
su distribución en los bordes y al interior de los
fragmentos de bosque.
Las investigaciones
epidemiológicas han ligado la exposición
al virus a una serie de actividades al aire libre tanto de
trabajo como
recreacionales. La exposición al interior de edificios
como graneros, bodegas, cabañas, casas habitación
se han considerado como invasiones de los roedores para evitar
las condiciones frías o para nidificar. Sin embargo
secuencias genéticas de virus en el roedor habitante
próximos a los casos pacientes han mostrado una estrecha
asociación entre los virus de estos (Schmaljohn y Hjelle,
1997; Hart y Bennett, 1999; Calderón y col., 1999). En la
patagonia Argentina se demostró identidad en un 100% del
nucleotido entre el virus presente en el roedor O. longicaudatus
capturado en el hogar del paciente enfermo por SPH (Cantoni y
col., 2001). Por otra parte, se ha observado que los roedores
capturados en edificios y habitaciones humanas constituyen mayor
riesgo de infección al hombre (Hjelle y Glass, 2000). Es
así como en un estudio realizado en la región de
cuatro esquinas de Estados Unidos,
la enorme mayoría de los casos pacientes con antecedentes
de exposición, estos fueron en ambientes de interiores de
edificios. (Hjelle y Glass, 2000). En Canadá se
encontró que roedores reservorios de virus SN (P.
maniculatus) son atraídos a los edificios donde encuentran
suministro de alimento concentrado, un moderado microclima, lo
que transforma a esta variable (edificio) en una
estadísticamente significativa con la incidencia del
virus. (Langlois y col., 2001). En las colectas de roedores
realizadas en Chile en el área peri doméstica al
caso paciente, su casa y bodegas aledañas, se han
capturados un mayor numero de individuos reservorios (O.
longicaudatus) positivos a Virus AND (Murúa y col.,
2003).
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |